Qual a temperatura de saturação da água?
Qual a temperatura de saturação da água?
Contenidos
temperatura de saturação da água à pressão atmosférica
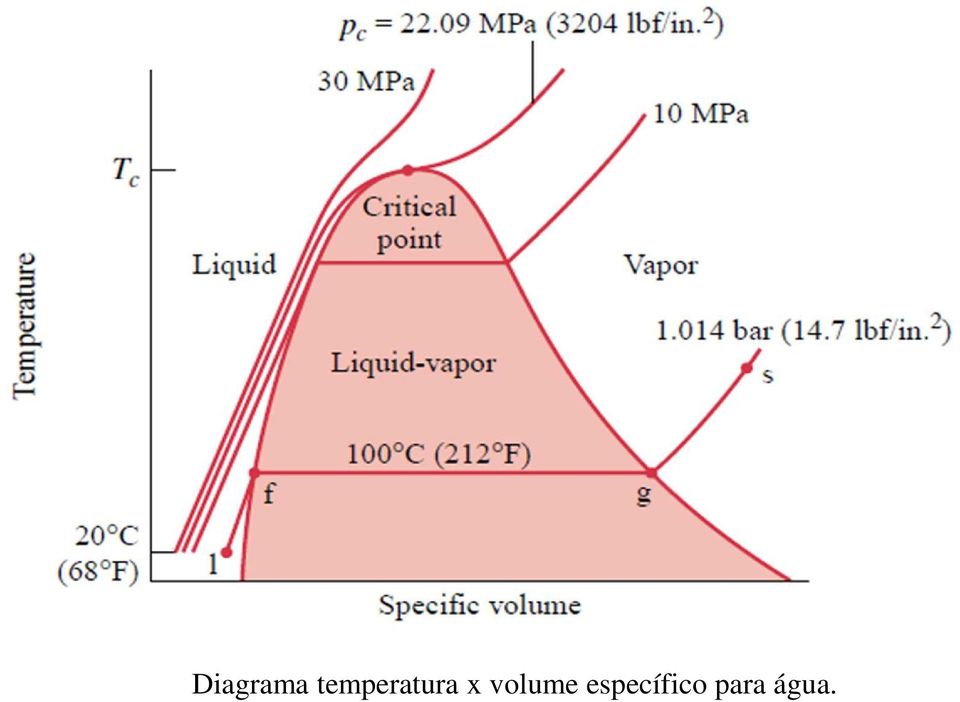
O ponto de ebulição de um líquido varia de acordo com a pressão ambiental ao redor. Um líquido em um vácuo parcial tem um ponto de ebulição menor do que quando esse líquido está à pressão atmosférica. Um líquido em alta pressão tem um ponto de ebulição maior do que quando esse líquido está à pressão atmosférica. Por exemplo, a água ferve a 100 °C (212 °F) ao nível do mar, mas a 93,4 °C (200,1 °F) a 1.905 metros (6.250 pés)[3] de altitude. Para uma determinada pressão, líquidos diferentes ferverão a temperaturas diferentes.
O ponto de ebulição normal (também chamado de ponto de ebulição atmosférico ou ponto de ebulição de pressão atmosférica) de um líquido é o caso especial no qual a pressão de vapor do líquido é igual à pressão atmosférica definida ao nível do mar, uma atmosfera.[4][5] A essa temperatura, a pressão de vapor do líquido torna-se suficiente para superar a pressão atmosférica e permitir a formação de bolhas de vapor dentro do volume do líquido. O ponto de ebulição padrão tem sido definido pela IUPAC desde 1982 como a temperatura na qual a ebulição ocorre sob uma pressão de uma barra[6].
tabela de temperatura da água saturada
O ponto de ebulição de um líquido varia de acordo com a pressão ambiental ao redor. Um líquido em um vácuo parcial tem um ponto de ebulição menor do que quando esse líquido está à pressão atmosférica. Um líquido em alta pressão tem um ponto de ebulição maior do que quando esse líquido está à pressão atmosférica. Por exemplo, a água ferve a 100 °C (212 °F) ao nível do mar, mas a 93,4 °C (200,1 °F) a 1.905 metros (6.250 pés)[3] de altitude. Para uma determinada pressão, líquidos diferentes ferverão a temperaturas diferentes.
O ponto de ebulição normal (também chamado de ponto de ebulição atmosférico ou ponto de ebulição de pressão atmosférica) de um líquido é o caso especial no qual a pressão de vapor do líquido é igual à pressão atmosférica definida ao nível do mar, uma atmosfera.[4][5] A essa temperatura, a pressão de vapor do líquido torna-se suficiente para superar a pressão atmosférica e permitir a formação de bolhas de vapor dentro do volume do líquido. O ponto de ebulição padrão tem sido definido pela IUPAC desde 1982 como a temperatura na qual a ebulição ocorre sob uma pressão de uma barra[6].
fórmula de temperatura de saturação
O ponto de ebulição de um líquido varia de acordo com a pressão ambiental ao redor. Um líquido em um vácuo parcial tem um ponto de ebulição menor do que quando esse líquido está à pressão atmosférica. Um líquido em alta pressão tem um ponto de ebulição maior do que quando esse líquido está à pressão atmosférica. Por exemplo, a água ferve a 100 °C (212 °F) ao nível do mar, mas a 93,4 °C (200,1 °F) a 1.905 metros (6.250 pés)[3] de altitude. Para uma determinada pressão, líquidos diferentes ferverão a temperaturas diferentes.
O ponto de ebulição normal (também chamado de ponto de ebulição atmosférico ou ponto de ebulição de pressão atmosférica) de um líquido é o caso especial no qual a pressão de vapor do líquido é igual à pressão atmosférica definida ao nível do mar, uma atmosfera.[4][5] A essa temperatura, a pressão de vapor do líquido torna-se suficiente para superar a pressão atmosférica e permitir a formação de bolhas de vapor dentro do volume do líquido. O ponto de ebulição padrão tem sido definido pela IUPAC desde 1982 como a temperatura na qual a ebulição ocorre sob uma pressão de uma barra[6].
Qual a temperatura de saturação da água? on line
S
